Tofacitinibcitrat ist ein verschreibungspflichtiges Medikament (Handelsname Xeljanz), das ursprünglich von Pfizer für eine Klasse oraler Januskinase (JAK)-Hemmer entwickelt wurde. Es kann die JAK-Kinase selektiv hemmen, die JAK/STAT-Signalwege blockieren und dadurch die Zellsignaltransduktion sowie die damit verbundene Genexpression und -aktivierung hemmen und wird zur Behandlung von rheumatoider Arthritis, Psoriasis-Arthritis, Colitis ulcerosa und anderen Immunerkrankungen eingesetzt.
Das Medikament umfasst drei Darreichungsformen: Tabletten, Retardtabletten und orale Lösungen. Seine Tabletten wurden erstmals 2012 von der FDA zugelassen, und die Darreichungsform mit verzögerter Freisetzung wurde im Februar 2016 von der FDA zugelassen. Es ist das erste Medikament zur Behandlung rheumatoider Gelenke. Yan ist ein JAK-Hemmer, der einmal täglich oral eingenommen wird. Im Dezember 2019 wurde erneut eine neue Indikation für Retardmedikamente bei mittelschwerer bis schwerer aktiver Colitis ulcerosa (UC) zugelassen. Darüber hinaus wurden die aktuellen klinischen Phase-3-Studien zur Plaque-Psoriasis abgeschlossen und weitere sechs klinische Phase-3-Studien zu aktiver Psoriasis-Arthritis, juveniler idiopathischer Arthritis usw. sind im Gange. Art der Indikationen. Die Vorteile von Retardtabletten, die lange wirken und nur einmal täglich eingenommen werden müssen, tragen zur Behandlung und Kontrolle der Krankheiten der Patienten bei.
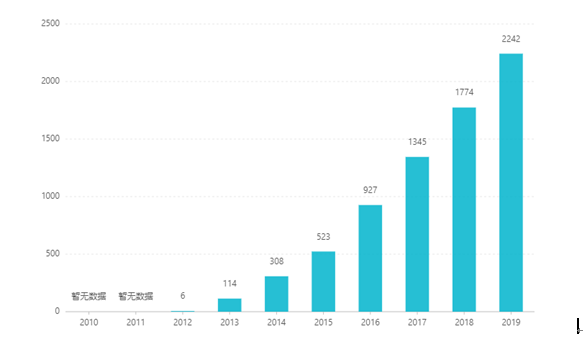
Seit der Börsennotierung ist der Umsatz Jahr für Jahr gestiegen und erreichte 2019 einen Wert von 2,242 Milliarden US-Dollar. In China wurde die Tablettenform im März 2017 für die Vermarktung zugelassen und 2019 durch Verhandlungen in den Katalog der Krankenversicherungskategorie B aufgenommen. Der jüngste Gewinner Das Gebot beträgt RMB 26,79. Aufgrund der hohen technischen Hürden von Retardpräparaten wurde diese Darreichungsform in China jedoch bisher nicht vermarktet.
JAK-Kinase spielt eine wichtige Rolle bei Entzündungen und ihre Inhibitoren können nachweislich bestimmte Entzündungs- und Autoimmunerkrankungen behandeln. Bisher wurden weltweit sieben JAK-Inhibitoren zugelassen, darunter Delgocitinib von Leo Pharma, Fedratinib von Celgene, Upatinib von AbbVie, Pefitinib von Astellas, Baritinib von Eli Lilly und Rocotinib von Novartis. Von den oben genannten Arzneimitteln sind in China jedoch nur Tofacitinib, Baritinib und Rocotinib zugelassen. Wir freuen uns darauf, dass die „Tofatib Citrate Retardtabletten“ von Qilu so bald wie möglich zugelassen werden und mehr Patienten zugute kommen.
In China wurde das ursprüngliche Forschungsprodukt Tofacitibcitrat im März 2017 von der NMPA unter dem Handelsnamen Shangjie für die Behandlung erwachsener RA-Patienten mit unzureichender Wirksamkeit oder Unverträglichkeit gegenüber Methotrexat zugelassen. Nach Angaben von Meinenet beliefen sich die Verkäufe von Tofacitib-Citrat-Tabletten in Chinas öffentlichen medizinischen Einrichtungen im Jahr 2018 auf 8,34 Millionen Yuan, was deutlich unter den weltweiten Verkäufen lag. Ein großer Teil des Grundes ist der Preis. Es wird berichtet, dass der anfängliche Verkaufspreis von Shangjie 2085 Yuan (5 mg*28 Tabletten) betrug und die monatlichen Kosten 4170 Yuan betrugen, was für normale Familien keine geringe Belastung darstellt.
Es lohnt sich jedoch zu feiern, dass Tofacitib nach Verhandlungen im November 2019 von der National Medical Insurance Administration in die „Nationale Arzneimittelliste für Grundkrankenversicherung, Arbeitsunfallversicherung und Mutterschaftsversicherung“ für 2019 aufgenommen wurde. Es wird berichtet, dass die monatliche Gebühr gesenkt wird nach Verhandlung der Preissenkung auf unter 2.000 Yuan sinken, was die Verfügbarkeit des Arzneimittels erheblich verbessern wird.
Im August 2018 beantragte das Patent Reexamination Board des State Intellectual Property Office mit der Überprüfungsentscheidung Nr. 36902 die Nichtigerklärung und erklärte das Kernpatent von Pfizertofatib, das Verbundpatent, aufgrund unzureichender Offenlegung der Spezifikation für ungültig. Das Patent der Pfizertofatiib-Kristallform (ZL02823587.8, CN1325498C, Anmeldedatum 25.11.2002) läuft jedoch im Jahr 2022 aus.
Die Insight-Datenbank zeigt, dass zusätzlich zur ursprünglichen Forschung fünf Generika von Chia Tai Tianqing, Qilu, Kelun, Yangtze River und Nanjing Chia Tai Tianqing für die Vermarktung in den inländischen Tofacitinib-Tablettenformulierungen zugelassen wurden. Für den Tablettentyp mit verzögerter Wirkstofffreisetzung hat jedoch am 26. Mai nur die ursprüngliche Forschungsfirma Pfizer einen Vermarktungsantrag eingereicht. Qilu ist das erste inländische Unternehmen, das einen Vermarktungsantrag für diese Formulierung eingereicht hat. Darüber hinaus befindet sich CSPC Ouyi in der BE-Testphase.
Changzhou Pharmaceutical Factory (CPF) ist ein führender pharmazeutischer Hersteller von Wirkstoffen und Fertigformulierungen in China mit Sitz in Changzhou, Provinz Jiangsu. CPF wurde 1949 gegründet. Seit 2013 beschäftigen wir uns mit Tofacitinibcitrat und haben bereits DMF eingereicht. Wir sind in vielen Ländern registriert und können Sie mit den besten Dokumentenunterstützung für Tofacitinibcitrat unterstützen.
Zeitpunkt der Veröffentlichung: 23. Juli 2021