Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) ist eine Hauptart von Herzinsuffizienz, und die China HF Study zeigte, dass 42 % der Herzinsuffizienz in China HFrEF sind, obwohl mehrere therapeutische Standard-Medikamentenklassen für HFrEF verfügbar sind und das Risiko reduziert haben von Tod und Krankenhauseinweisung wegen Herzinsuffizienz bis zu einem gewissen Grad.Die Patienten haben jedoch ein hohes Risiko für wiederkehrende Herzinsuffizienz-Verschlimmerungsereignisse, die Sterblichkeit bleibt bei etwa 25 % und die Prognose bleibt schlecht.Daher besteht nach wie vor ein dringender Bedarf an neuen Therapeutika zur Behandlung von HFrEF, und Vericiguat, ein neuartiger Stimulator der löslichen Guanylatcyclase (sGC), wurde in der VICTORIA-Studie untersucht, um zu beurteilen, ob Vericiguat die Prognose von Patienten mit HFrEF verbessern könnte.Die Studie ist eine multizentrische, randomisierte, Placebo-kontrollierte, doppelblinde, ereignisgesteuerte Phase-III-Studie mit klinischen Ergebnissen in Parallelgruppen.An der Studie, die unter der Schirmherrschaft des VIGOR Centre in Kanada in Zusammenarbeit mit dem Duke Clinical Research Institute durchgeführt wurde, nahmen 616 Zentren in 42 Ländern und Regionen, darunter Europa, Japan, China und die Vereinigten Staaten, teil.Unsere kardiologische Abteilung hatte die Ehre, daran teilzunehmen.Insgesamt 5.050 Patienten mit chronischer Herzinsuffizienz im Alter von ≥ 18 Jahren, NYHA-Klassen II-IV, EF < 45 %, mit erhöhten natriuretischen Peptid (NT-proBNP)-Spiegeln innerhalb von 30 Tagen vor der Randomisierung und die wegen Herzinsuffizienz ins Krankenhaus eingeliefert worden waren innerhalb von 6 Monaten vor der Randomisierung oder intravenös verabreichte Diuretika wegen Herzinsuffizienz innerhalb von 3 Monaten vor der Randomisierung in die Studie aufgenommen wurden, alle erhielten ESC, AHA/ACC und die von den nationalen/regionalen Richtlinien empfohlenen Behandlungsstandards.Die Patienten wurden im Verhältnis 1:1 in zwei Gruppen randomisiert und erhielten eine DosisVericiguat(n=2526) bzw. Placebo (n=2524) zusätzlich zur Standardtherapie.
Der primäre Endpunkt der Studie war der kombinierte Endpunkt aus kardiovaskulärem Tod oder erster Krankenhauseinweisung wegen Herzinsuffizienz;Zu den sekundären Endpunkten gehörten Komponenten des primären Endpunkts, erste und nachfolgende Krankenhauseinweisungen wegen Herzinsuffizienz (erste und wiederkehrende Ereignisse), der kombinierte Endpunkt aus Gesamttod oder Krankenhauseinweisung wegen Herzinsuffizienz und Gesamttod.Bei einer medianen Nachbeobachtungszeit von 10,8 Monaten gab es in der Vericiguat-Gruppe im Vergleich zur Placebo-Gruppe eine relative Reduktion des primären Endpunkts, kardiovaskulärer Tod oder erste Hospitalisierung wegen Herzinsuffizienz, um 10 %.
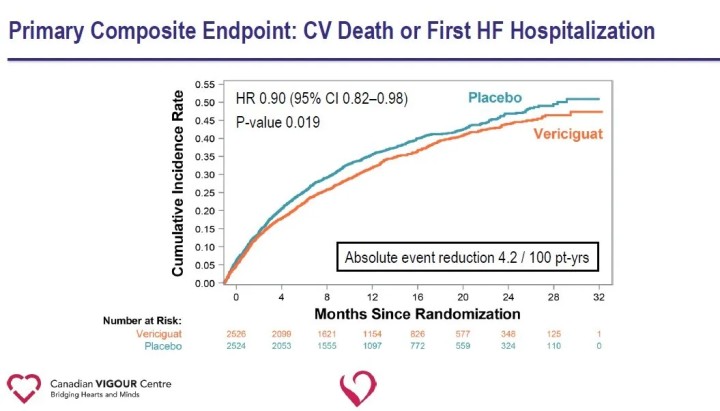
Die Analyse der sekundären Endpunkte zeigte in der Vericiguat-Gruppe im Vergleich zur Placebo-Gruppe eine signifikante Reduzierung der Krankenhauseinweisungen wegen Herzinsuffizienz (HR 0,90) und eine signifikante Reduzierung des zusammengesetzten Endpunkts aus Tod jeglicher Ursache oder Krankenhauseinweisung wegen Herzinsuffizienz (HR 0,90).
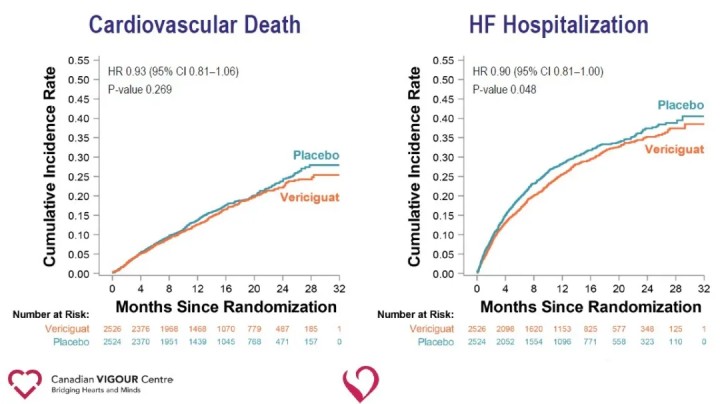
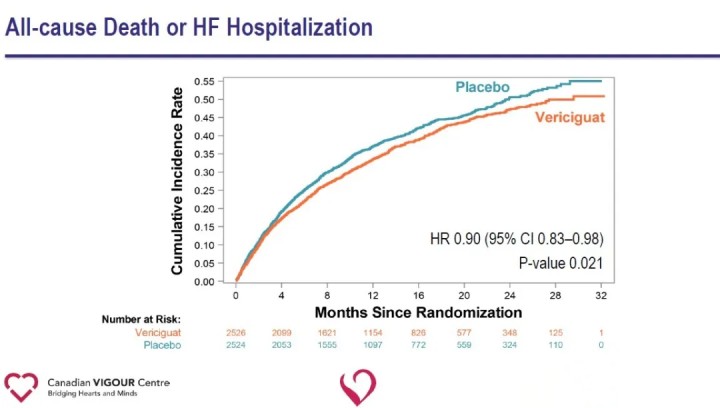
Die Ergebnisse der Studie legen nahe, dass die Zugabe vonVericiguatauf die Standardbehandlung von Herzinsuffizienz reduziert signifikant das kürzliche Auftreten von sich verschlimmernden Herzinsuffizienzereignissen und reduziert das Risiko des kombinierten Endpunkts kardiovaskulärer Tod oder Krankenhauseinweisung wegen Herzinsuffizienz bei Patienten mit HFrEF.Die Fähigkeit von Vericiguat, das Risiko des kombinierten Endpunkts kardiovaskulärer Tod oder Krankenhauseinweisung wegen Herzinsuffizienz bei Patienten mit Hochrisiko-Herzinsuffizienz zu reduzieren, bietet einen neuen therapeutischen Weg für Herzinsuffizienz und eröffnet neue Wege für die zukünftige Erforschung von Herz-Kreislauf-Erkrankungen.Vericiguat ist derzeit nicht für die Vermarktung zugelassen.Die Sicherheit, Wirksamkeit und Wirtschaftlichkeit des Medikaments müssen noch weiter auf dem Markt getestet werden.
Postzeit: 09.02.2022
